- TOP
- よくわかるLAMP法
- 試薬調製
試薬調製
プライマー調製
プライマー溶液の調製(氷上操作、クリーンベンチ内で実施)
合成プライマーが含まれるチューブに、データシートに記載量のTE Buffer(10mM Tris-HCl (pH8.0) ,1mM EDTA (pH8.0))を添加し、各プライマーを100 pmol/μLに調製します。


プライマー到着時の状態
左:株式会社ニッポンジーン マテリアル
右:ユーロフィンジェノミクス株式会社
- お届けの包装が多少異なる場合がありますのでご了承ください。
プライマーミックスの調整(氷上操作、クリーンベンチ内で実施)
100 pmol/μLに調製した各プライマーを用い、 滅菌マイクロチューブに1反応あたりFIP/BIP各40 pmol、F3/B3各5 pmol、Loop Primer F(FL)/ Loop Primer B (BL)各20 pmolが入るようにプライマーミックスを調製します。以下は100反応分の調製例となります。調製後、使いやすい分量(例:10検体分)に小分け分注して凍結保存(-20℃)します。
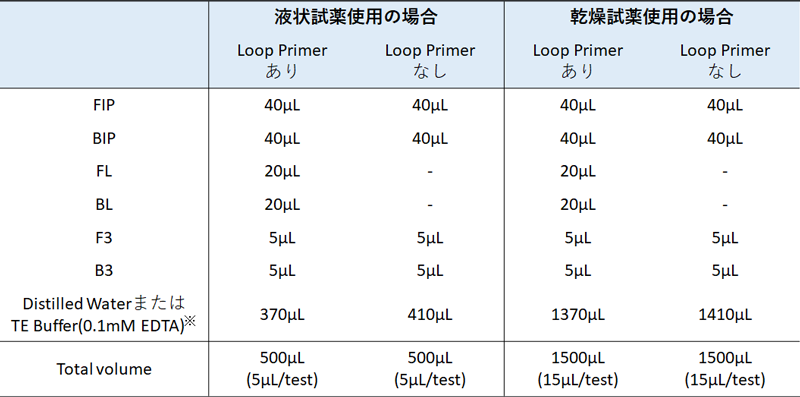
-
TE Buffer(0.1mM EDTA) :10mM Tris-HCl (pH8.0) ,0.1mM EDTA (pH8.0)
反応液中のEDTA濃度が高くならないよう0.1mM EDTAを使用 - プライマー組成が決定していない場合またはプライマーの長期保存が想定される場合にはプライマーミックスではなく個々のプライマーで凍結保存することを推奨します。
プライマーに関するQ&A
- 合成プライマーをどのように溶解したらいいのですか?
-
滅菌済み緩衝液(TE Buffer※等)で溶解してください。
TE Buffer (10mM Tris-HCl (pH8.0) ,1mM EDTA (pH8.0)) - 合成プライマーはどれくらいの期間使用できますか、またどのように保存すべきでしょうか?
- 未修飾合成プライマーは安定分子であり、溶解後-20℃で保存して頂ければ、少なくとも12ヶ月はご使用になれます。また、凍結融解の繰り返しは合成プライマーの物理的な分解を引き起こすため、同じ配列を用いて多くの実験を行うのであれば、プライマーはいくつかに分けて保存してください。合成プライマーは、一般的に水に溶解するよりもTE Bufferに溶解するほうが長期間保存できます。
- オリゴヌクレオチドの定量はどのようにするのですか?
- 通常、オリゴヌクレオチドは波長260nmにおけるUV吸収の測定によって定量されます。 33μg/mLの濃度において中性水溶液に溶解された一本鎖オリゴヌクレオチドは、波長260nmにおいて約1.0 A.U.の吸収をもちます。OD単位は吸光度(1cmのセル使用で波長260nm)にサンプルの容量(mL)を掛けたものとして定義されます。すなわち、1ODは一本鎖DNA約33μgに相当します。
反応試薬の調製
反応試薬調製時の注意点
- 反応試薬調製は、試薬の劣化を防ぐために氷上で行う。
- マスターミックスおよび反応液は十分に混合する。ただし、酵素はボルテックスにより失活するので、ピペッティングあるいは転倒混和により撹拌する。撹拌後は軽くスピンダウンする。
- 反応液に気泡が生じた場合は転倒混和・遠心により取り除く。
コンタミネーションを防ぐ
LAMP反応は非常に鋭敏な反応であり、鋳型となるDNA/RNAがごく微量でも混入すると誤った結果をもたらす原因となります。このようなコンタミネーションを防ぐために、試薬調製は下記の点に注意してください。
- 試薬及びサンプルを調製する部屋と、増幅産物を扱う部屋はできる限り分ける。
- 試薬調製はクリーンベンチを使用し、作業中は手袋を着用する。
- 試薬調製とサンプル添加は明確に作業エリアを分け、ピペット等もそれぞれ専用とする
液状試薬の場合
以下に、Loopamp DNA増幅試薬キットを使用した試薬調製例を示します。 Loopamp RNA増幅試薬キット(RT-LAMP)も同様の操作となります。
-
マスターミックスの調製(氷上操作、クリーンベンチ内で実施)
滅菌マイクロチューブに各試薬を必要なテスト数分、下表の割合(1 テストあたり)で分注しマスターミックスとします。
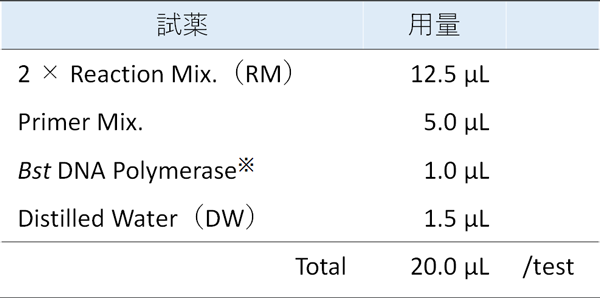
- RNA増幅試薬キットの場合は、Bst DNA Polymerase の代わりにEnzyme Mix.(EM)を添加
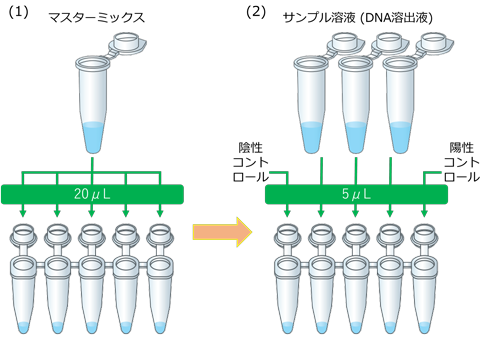
- マスターミックスとサンプル/コントロールの混合(氷上操作、クリーンベンチ外で実施)
- 反応チューブに、マスターミックス20μLを分注します。
- サンプル溶液またはコントロールを5μL添加し全量25μLとします。陽性コントロールは必ず最後に添加してください。
- フタを閉めた後、反応チューブを5回転倒混和、スピンダウンし、LAMP反応を行います。
乾燥試薬の場合
以下に、Loopamp DNA増幅試薬Dを使用した準備例を示します。 Loopamp RNA/DNA増幅試薬 Dも同様の操作となります。
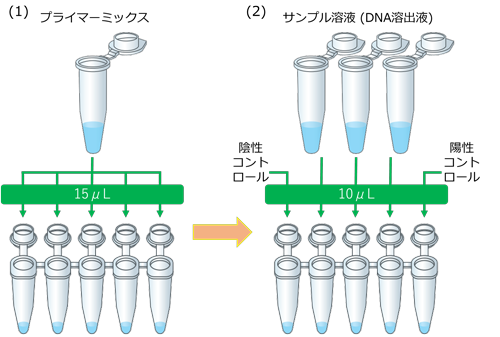
- 乾燥試薬の準備(氷上操作)
- 反応チューブ( Dried DNA Amplification Reagent )に、プライマーミックス15μLを分注します。
- サンプル溶液またはコントロールを10μL添加し全量25μLとします。陽性コントロールは必ず最後に添加してください。
- フタを閉めた後、反応チューブを転倒して溶液をフタに移し、転倒状態のまま氷上で2分間静置します。
- 反応チューブを5回転倒混和、スピンダウンし、LAMP反応を行います。
- 乾燥試薬の補足情報
乾燥試薬では、同じプライマーを用いても、液状試薬と比較して、反応が遅延する場合があります。その際には、 Loopamp DNA増幅試薬Dの製品ページにあります「【技術レポート】各種プライマーセット製品との反応性確認」を参考にKCl溶液を添加することで、反応が改善されます。