- TOP
- 製品情報
- Loopamp製品(臨床検査分野) 一覧
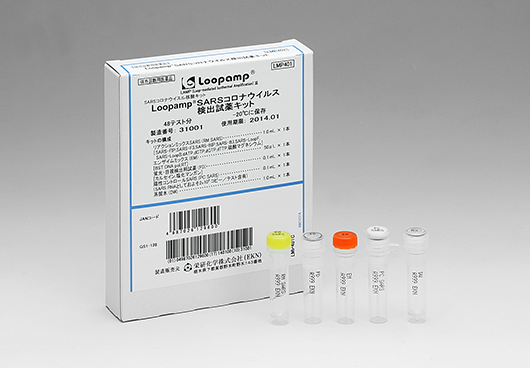
- Loopamp SARSコロナウイルス検出試薬キット
SARSコロナウイルス核酸キット Loopamp SARSコロナウイルス検出試薬キット
製品概要
- RT-LAMP法によりヒト由来検体中のSARSコロナウイルスRNAを特異的に検出します。
- RT-LAMP法とはLAMP法を応用し逆転写酵素を用いてRNAをターゲットとして増幅を行う核酸増幅法です。
- 本製品は液状凍結試薬です。測定には別途、専用の反応チューブが必要です。
- LAMP反応に要する時間は約45分です。
- リアルタイム濁度測定装置により逆転写反応から増幅反応、検出までをワンステップで行います。
使用目的
糞便・鼻腔咽頭拭い液から抽出されたSARSコロナウイルスRNAの検出(SARSが疑われる有症状者を対象とする診断の補助)
製品仕様
| 製品名 | Loopamp SARSコロナウイルス検出試薬キット |
| 測定方法 | LAMP法(定性検出キット) |
| 対象検体 | 糞便・鼻腔咽頭拭い液 |
| 最小検出感度 | 10コピー/テスト |
| 製品コード | LMP401 |
| 包装単位 | 48テスト分 |
| 貯蔵方法 | −20℃ |
| 有効期間 | 6ヵ月間 |
| キットの構成 | リアクションミックスSARS(RM SARS)・・・ 1.0 mL×1 エンザイムミックス(EM)・・・ 50 μL×1 蛍光・目視検出用試薬(FD)・・・ 0.1 mL×1 陽性コントロールSARS(PC SARS)・・・ 0.1 mL×1 蒸留水(DW)・・・ 1.0 mL×1 |
- Loopampは栄研化学株式会社の登録商標です。
使用上又は取扱い上の注意については添付文書をご参照ください。(情報提供年月:2021年7月)
重要な基本的注意
- 本製品の検査対象はSARSが疑われる有症状者とすること。
- 本製品で判定が陰性であっても、疾患としてのSARS感染を否定するものではない。
- 診断はWHOの最新の症例定義を参照し、臨床症状も含めて総合的に判断すること。本製品はあくまでSARSが疑われる有症状者を対象とする診断の補助を行うためのものである。
- 本製品の臨床性能試験におけるSRAS患者検体の陽性率は次のとおりであった。
SARS発症当時のWHOの症例定義に従ってSARS可能性例とみなされた症例から得られた検体について、リアルタイム濁度検出による陽性率は、検体別に糞便:81.0%(64/79)、鼻腔咽頭拭い液:56.3%(9/16)であった。また、蛍光目視検出による陽性率はそれぞれ順に、77.2%(61/79), 56.3%(9/16)であった。
一方、非SARS患者、不明(施設が非SARS患者と考えている例)、健常人の血清及び血漿、その他の97検体は、本製品によるリアルタイム濁度検出、蛍光目視検出ともにすべて陰性であった。
検体は糞便を第一選択とする。鼻腔咽頭拭い液についても検体とすることが可能である。 - 検体採取、取扱いについては必要なバイオハザード対策をとること。(詳細は添付文書【操作上の注意】参照。)
- 反応後のチューブのキャップは決して開けないこと。
他検体の増幅産物によるコンタミネーションは誤判定の原因となるばかりでなく、試験環境そのものを汚染し、汚染を除去しない限り、以後の試験で正しい結果が得られなくなる可能性がある。
関連製品
お問い合わせ
本製品の製造販売元は栄研化学株式会社です。
製品および購入に関するお問い合わせは お問い合わせフォーム よりお願いいたします。
ピックアップ製品
NEW Loopamp マラリアPan検出試薬キット、他2品目
Loopamp 新型コロナウイルス2019(SARS-CoV-2)検出試薬キット
Loopamp Aspergillus fumigatus 検出試薬キット